Bagaimana baterai bekerja dan bekerja
 Dalam arti kata yang paling luas dalam teknologi, istilah "baterai" mengacu pada perangkat yang memungkinkan dalam kondisi operasi tertentu untuk mengakumulasi jenis energi tertentu, dan pada orang lain menggunakannya untuk kebutuhan manusia.
Dalam arti kata yang paling luas dalam teknologi, istilah "baterai" mengacu pada perangkat yang memungkinkan dalam kondisi operasi tertentu untuk mengakumulasi jenis energi tertentu, dan pada orang lain menggunakannya untuk kebutuhan manusia.
Mereka digunakan jika diperlukan untuk mengumpulkan energi untuk waktu tertentu dan kemudian menggunakannya untuk melakukan proses padat karya yang besar. Misalnya, akumulator hidrolik yang digunakan pada kunci memungkinkan kapal naik ke tingkat yang baru di dasar sungai.
Baterai listrik bekerja dengan listrik dengan prinsip yang sama: pertama, mereka mengakumulasi (mengumpulkan) listrik dari sumber pengisian daya eksternal dan kemudian memberikannya kepada konsumen yang terhubung untuk melakukan pekerjaan. Berdasarkan sifatnya, mereka termasuk sumber arus kimia yang mampu melakukan siklus pelepasan dan pengisian berkala berulang kali.
Selama operasi, reaksi kimia terus-menerus terjadi antara komponen pelat elektroda dengan bahan pengisinya - elektrolit.
Diagram skema perangkat baterai dapat direpresentasikan dengan gambar yang disederhanakan ketika dua pelat dari logam yang berbeda dengan kabel dimasukkan ke dalam badan kapal untuk menyediakan kontak listrik. Elektrolit dituangkan di antara pelat.
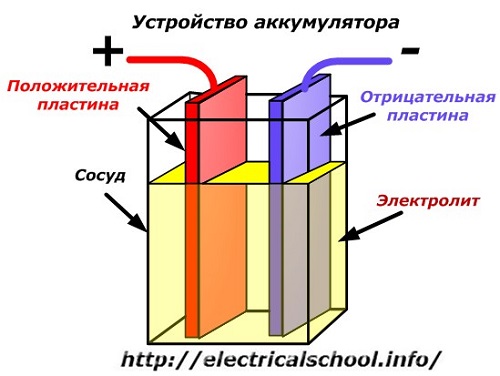
Pengoperasian baterai saat habis
Ketika beban, seperti bola lampu, dihubungkan ke elektroda, sirkuit listrik tertutup dibuat di mana arus pelepasan mengalir. Itu dibentuk oleh pergerakan elektron di bagian logam dan anion dengan kation di elektrolit.
Proses ini secara konvensional ditunjukkan pada diagram dengan desain elektroda nikel-kadmium.
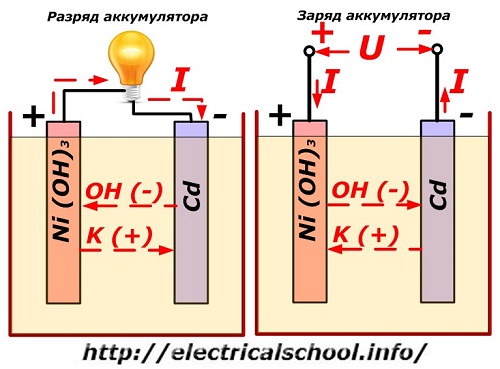
Di sini, oksida nikel dengan aditif grafit, yang meningkatkan konduktivitas listrik, digunakan sebagai bahan elektroda positif. Logam dari elektroda negatif adalah kadmium spons.
Selama pelepasan, partikel oksigen aktif dari oksida nikel dilepaskan ke dalam elektrolit dan diarahkan ke pelat negatif, tempat kadmium teroksidasi.
Performa baterai saat mengisi daya
Ketika beban dimatikan, tegangan konstan (dalam situasi tertentu, berdenyut) diterapkan ke terminal pelat dengan nilai lebih besar daripada baterai yang diisi dengan polaritas yang sama, ketika terminal plus dan minus dari sumber dan konsumen bertepatan. .
Pengisi daya selalu memiliki lebih banyak daya, yang "menekan" sisa energi dalam baterai dan menciptakan arus listrik ke arah pelepasan yang berlawanan. Akibatnya, proses kimia internal antara elektroda dan elektrolit berubah. Misalnya, pada sekotak pelat nikel-kadmium, elektroda positif diperkaya dengan oksigen, dan negatif - ke keadaan kadmium murni.
Saat baterai dikosongkan dan diisi, komposisi kimia bahan pelat (elektroda) berubah, tetapi elektrolitnya tidak berubah.
Metode koneksi baterai
Koneksi paralel
Jumlah arus pelepasan yang dapat ditahan seseorang bergantung pada banyak faktor, tetapi terutama desain, bahan yang digunakan, dan dimensinya. Semakin besar luas pelat pada elektroda, semakin besar arus yang dapat ditahannya.
Prinsip ini digunakan untuk menghubungkan sel-sel dengan tipe yang sama secara paralel dalam baterai ketika diperlukan untuk meningkatkan arus ke beban, tetapi untuk mengisi daya desain seperti itu, perlu untuk meningkatkan daya sumber. Metode ini jarang digunakan untuk struktur yang sudah jadi, karena sekarang jauh lebih mudah untuk segera membeli baterai yang diperlukan. Tetapi produsen baterai asam menggunakannya, menghubungkan pelat yang berbeda menjadi satu blok.
Koneksi seri
Bergantung pada bahan yang digunakan, tegangan 1,2 / 1,5 atau 2,0 volt dapat dihasilkan antara dua pelat elektroda baterai yang biasa digunakan dalam kehidupan sehari-hari. (Sebenarnya, kisaran ini jauh lebih luas.) Jelas, ini tidak cukup untuk banyak perangkat listrik. Oleh karena itu, baterai dengan jenis yang sama dihubungkan secara seri, dan ini sering dilakukan dalam satu wadah.
Contoh dari desain semacam itu adalah perkembangan otomotif yang meluas berdasarkan asam sulfat dan pelat elektroda timbal.
Biasanya, di kalangan masyarakat, terutama di kalangan pengemudi angkutan, perangkat apa pun biasa disebut baterai, terlepas dari jumlah elemen penyusunnya - kotak. Namun, ini tidak sepenuhnya benar.Strukturnya, yang dirangkai dari beberapa kotak yang dihubungkan secara seri, sudah menjadi baterai, yang disingkat nama «АКБ» dibubuhkan... Struktur internalnya ditunjukkan pada gambar.
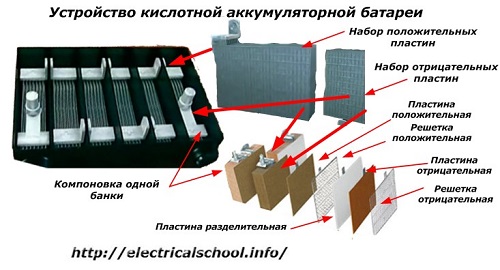
Masing-masing toples terdiri dari dua blok dengan satu set pelat untuk elektroda positif dan negatif. Blok cocok satu sama lain tanpa kontak logam dengan kemungkinan sambungan galvanik yang andal melalui elektrolit.
Dalam hal ini, pelat kontak memiliki kisi tambahan dan dipisahkan satu sama lain oleh pelat pemisah.
Menghubungkan pelat dalam balok meningkatkan area kerjanya, mengurangi resistansi total seluruh struktur dan memungkinkan Anda meningkatkan daya beban yang terhubung.
Di luar kotak, baterai semacam itu memiliki elemen yang ditunjukkan pada gambar di bawah.
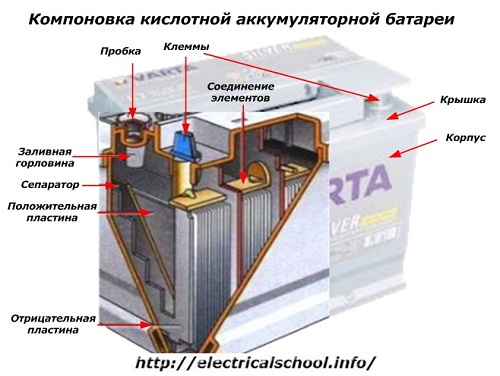
Terlihat bahwa rumah plastik yang kokoh disegel dengan penutup dan dilengkapi dengan dua terminal (biasanya berbentuk kerucut) di bagian atas untuk disambungkan ke sirkuit kelistrikan mobil. Tanda polaritas dicap pada terminalnya: «+» dan «-«. Biasanya terminal positif memiliki diameter yang sedikit lebih besar daripada terminal negatif untuk memblokir kesalahan pengkabelan.
Baterai yang dapat diservis memiliki lubang pengisi di bagian atas setiap tabung untuk mengontrol level elektrolit atau menambahkan air sulingan selama pengoperasian. Steker disekrup ke dalamnya, yang melindungi rongga internal casing dari kontaminasi dan pada saat yang sama mencegah elektrolit tumpah saat baterai dimiringkan.
Karena dengan muatan yang kuat, gas dari elektrolit dimungkinkan (dan proses ini dimungkinkan selama mengemudi intensif), lubang dibuat di sumbat untuk mencegah tekanan di dalam kotak meningkat.Oksigen dan hidrogen, serta uap elektrolit, keluar melaluinya. Disarankan untuk menghindari situasi seperti itu yang melibatkan arus pengisian yang berlebihan.
Gambar yang sama menunjukkan hubungan elemen antara tepian dan susunan pelat elektroda.
Baterai starter mobil (asam timbal) bekerja dengan prinsip sulfasi ganda. Selama pengosongan / pengisian, terjadi proses elektrokimia padanya, disertai dengan perubahan komposisi kimia massa aktif elektroda dengan pelepasan / penyerapan air dalam elektrolit (asam sulfat).
Ini menjelaskan peningkatan berat jenis elektrolit saat mengisi daya dan penurunan saat baterai habis. Dengan kata lain, nilai kerapatan memungkinkan Anda menilai kondisi kelistrikan baterai. Alat khusus digunakan untuk mengukurnya - hidrometer mobil.
Air suling, yang merupakan bagian dari elektrolit baterai asam, berubah menjadi padat - es suhu negatif... Oleh karena itu, untuk mencegah aki mobil membeku dalam cuaca dingin, perlu diterapkan tindakan khusus yang diatur dalam peraturan untuk eksploitasi.
Jenis baterai apa yang ada?
Produksi modern untuk berbagai keperluan menghasilkan lebih dari tiga lusin produk dengan komposisi elektroda dan elektrolit yang berbeda. 12 model yang dikenal hanya menggunakan lithium.

Berikut ini dapat ditemukan sebagai logam elektroda:
-
memimpin;
-
besi;
-
litium;
-
titanium;
-
kobalt;
-
kadmium;
-
nikel;
-
seng;
-
perak;
-
vanadium;
-
aluminium
-
beberapa item lainnya.
Mereka mempengaruhi karakteristik keluaran listrik dan oleh karena itu aplikasinya.
Kemampuan menahan beban tinggi jangka pendek akibat perputaran poros engkol mesin pembakaran internal oleh motor starter elektrik merupakan ciri khas baterai timbal-asam. Mereka banyak digunakan dalam transportasi, catu daya tak terputus dan sistem tenaga darurat.
Standar sel galvanik (baterai biasa) biasanya diganti dengan baterai nikel-kadmium, nikel-seng dan nikel-logam hidrida.
Tetapi desain litium-ion atau litium-polimer bekerja dengan andal di perangkat seluler dan komputasi, alat konstruksi, dan bahkan kendaraan listrik.
Menurut jenis elektrolit yang digunakan, baterai adalah:
-
kecut
-
basa.
Ada klasifikasi baterai menurut tujuannya. Misalnya, dalam kondisi modern, muncul perangkat yang digunakan untuk transfer energi - mengisi ulang sumber lain. Yang disebut baterai eksternal membantu pemilik banyak perangkat seluler tanpa adanya jaringan listrik bolak-balik. Itu dapat berulang kali mengisi daya tablet, smartphone, ponsel.
Semua baterai ini memiliki prinsip pengoperasian yang sama dan perangkat yang serupa. Misalnya, model jari lithium-ion yang ditunjukkan pada gambar di bawah sebagian besar mengulangi desain baterai asam yang dibahas sebelumnya.
Di sini kita melihat elektroda kontak yang sama, pelat, pemisah dan rumahan. Hanya mereka yang dibuat dengan mempertimbangkan kondisi kerja lainnya.
Karakteristik kelistrikan dasar baterai
Pengoperasian perangkat dipengaruhi oleh parameter:
-
kapasitas;
-
kepadatan energi;
-
debit diri;
-
rezim suhu.
Kapasitas disebut muatan maksimum baterai, yang mampu diberikannya selama pengosongan ke tegangan terendah. Itu dinyatakan dalam liontin (sistem SI) dan ampere-jam (unit non-sistem).
Sebagai jenis kapasitas ada «kapasitas energi», yang menentukan energi yang dilepaskan selama pelepasan tegangan minimum yang diijinkan. Itu diukur dalam joule (SI) dan watt-jam (satuan non-SI).
Kepadatan energi dinyatakan sebagai rasio jumlah energi terhadap berat atau volume baterai.
Self-discharge mempertimbangkan hilangnya kapasitas setelah pengisian tanpa adanya beban pada terminal. Ini tergantung pada desain dan diperburuk oleh kerusakan isolasi antara elektroda karena berbagai alasan.
Temperatur pengoperasian memengaruhi sifat kelistrikan dan jika terjadi penyimpangan serius dari norma yang ditentukan oleh pabrikan, ini dapat merusak baterai. Panas dan dingin tidak dapat diterima, mereka memengaruhi jalannya reaksi kimia dan tekanan lingkungan di dalam kotak.
