Dielektrik polar dan non-polar
Menurut pandangan fisika klasik, dielektrik pada dasarnya berbeda dengan konduktor, karena dalam kondisi normal tidak terdapat muatan listrik bebas di dalamnya. Muatan total partikel yang membentuk molekul dielektrik adalah nol. Namun, ini tidak berarti sama sekali bahwa molekul zat ini tidak mampu menunjukkan sifat listrik.
Semua dielektrik linier yang diketahui dapat dibagi menjadi dua kelompok besar: dielektrik polar dan dielektrik nonpolar. Pembagian ini diperkenalkan karena perbedaan mekanisme polarisasi molekul dari setiap jenis dielektrik. Faktanya, mekanisme polarisasi ternyata menjadi aspek yang sangat penting dalam mempelajari sifat fisik dan kimia dielektrik, dan dalam mempelajari sifat kelistrikannya.
dielektrik nonpolar
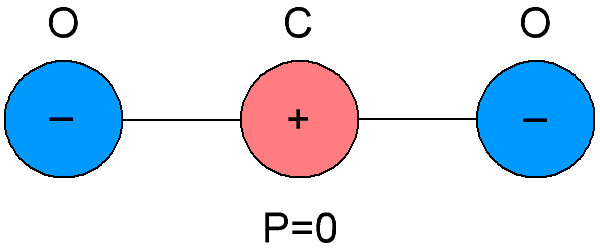
Dielektrik non-polar juga disebut dielektrik netral, karena molekul penyusun dielektrik ini berbeda dalam kebetulan pusat gravitasi dari muatan negatif dan positif di dalamnya.Alhasil, ternyata molekul dielektrik non-polar tidak memiliki momen listriknya sendiri, yaitu sama dengan nol. Dan dengan tidak adanya medan listrik eksternal, muatan positif dan negatif dari molekul zat tersebut diatur secara simetris.
Jika medan listrik eksternal diterapkan pada dielektrik non-polar, maka muatan positif dan negatif dalam molekul akan dipindahkan dari posisi kesetimbangan semula, molekul akan menjadi dipol yang momen listriknya sekarang akan sebanding dengan kekuatan listrik. bidang yang diterapkan padanya, dan akan diarahkan sejajar dengan bidang tersebut.
Contoh dielektrik non-polar yang berhasil digunakan saat ini sebagai bahan isolasi listrik adalah sebagai berikut: polietilen, polistiren, hidrokarbon, minyak isolasi minyak bumi, dll. Juga, perwakilan terang dari molekul non-polar adalah, misalnya, nitrogen, karbon dioksida, metana, dll. Tn.
Dielektrik nonpolar, karena nilai tangen kerugian dielektriknya yang rendah, banyak digunakan sebagai dielektrik frekuensi tinggi dalam kapasitor seperti K78-2.
Dielektrik kutub
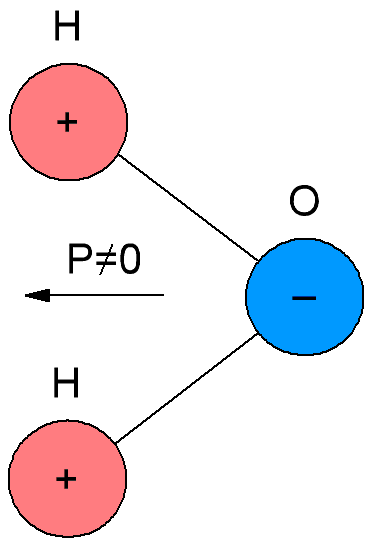
Dalam dielektrik polar, yang juga disebut dielektrik dipol, molekul memiliki momen listriknya sendiri, yaitu molekulnya bersifat polar. Alasannya adalah molekul dielektrik polar memiliki struktur asimetris, sehingga pusat massa muatan negatif dan positif dalam molekul dielektrik tersebut tidak bertepatan.
Jika dalam polimer non-polar beberapa atom hidrogen digantikan oleh atom unsur lain atau oleh radikal non-hidrokarbon, maka kita hanya akan mendapatkan dielektrik polar (dipol), karena simetri akan rusak sebagai akibat dari hal tersebut. penggantian. Menentukan polaritas suatu zat berdasarkan rumus kimianya, peneliti tentunya harus memiliki gambaran tentang struktur spasial molekulnya.
Ketika tidak ada medan listrik eksternal, sumbu dipol molekul diorientasikan secara sewenang-wenang karena gerakan termal, sehingga pada permukaan dielektrik dan di setiap elemen volumenya, muatan listrik rata-rata nol. Namun, ketika dielektrik diperkenalkan ke medan eksternal, orientasi parsial dipol molekul terjadi, akibatnya, muatan yang terhubung secara makroskopik muncul di permukaan dielektrik, menciptakan medan yang diarahkan ke medan eksternal.
Contoh dielektrik polar meliputi: hidrokarbon terklorinasi, resin epoksi dan fenol formaldehida, senyawa silikon silikon, dll. Molekul air dan alkohol, misalnya, juga merupakan contoh molekul polar yang terkenal. Dielektrik kutub banyak digunakan di berbagai bidang teknologi, seperti piezoelektrik dan feroelektrik, optik, optik nonlinier, elektronik, akustik, dll.

