Hukum elektrolisis Faraday
Hukum elektrolisis Faraday adalah hubungan kuantitatif berdasarkan penelitian elektrokimia Michael Faraday, yang diterbitkannya pada tahun 1836.
Hukum-hukum ini menentukan hubungan antara jumlah zat yang dilepaskan selama elektrolisis dan jumlah listrik yang melewati elektrolit. Hukum Faraday ada dua. Dalam literatur ilmiah dan buku teks, ada formulasi yang berbeda dari undang-undang ini.
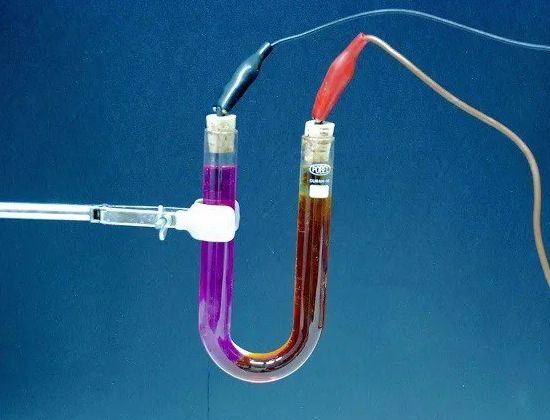
Elektrolisa - pelepasan dari elektrolit zat penyusunnya selama perjalanan listrik… Misalnya, ketika arus listrik melewati air yang sedikit diasamkan, air terurai menjadi bagian-bagian komponennya - gas (oksigen dan hidrogen).
Jumlah zat yang dilepaskan dari elektrolit sebanding dengan jumlah listrik yang melewati elektrolit, yaitu hasil kali kekuatan arus dengan waktu selama arus ini mengalir. Oleh karena itu, fenomena elektrolisis dapat berfungsi untuk mengukur kekuatan arus dan menentukan unit saat ini.
Elektrolit — larutan dan umumnya cairan kompleks yang menghantarkan arus listrik.Dalam baterai, elektrolitnya adalah larutan asam sulfat (dalam timbal) atau larutan kalium kaustik atau soda kaustik (dalam besi-nikel). Dalam sel galvanik, larutan senyawa kimia apa pun (amonia, tembaga sulfat, dll.) Juga berfungsi sebagai elektrolit.
Michael Faraday (1791 - 1867)
Michael Faraday (1791 — 1867) — fisikawan Inggris, pendiri doktrin modern tentang fenomena elektromagnetik. Dia memulai kehidupan kerjanya sebagai magang di bengkel penjilidan buku. Dia hanya mengenyam pendidikan dasar, tetapi mempelajari sains secara mandiri dan bekerja sebagai asisten laboratorium untuk ahli kimia Devi, dia menjadi ilmuwan hebat, salah satu fisikawan eksperimental terhebat.
Farraday terbuka fenomena induksi elektromagnetik, hukum elektrolisis, mengembangkan doktrin medan listrik dan magnet dan meletakkannya dasar konsep medan elektromagnetik modern… Dia adalah ilmuwan pertama yang memiliki gagasan tentang getaran, sifat gelombang dari fenomena elektromagnetik.
Hukum pertama elektrolisis Faraday
Massa suatu zat yang akan mengendap pada elektroda selama elektrolisis berbanding lurus dengan jumlah listrik yang ditransfer ke elektroda tersebut (melewati elektrolit). Jumlah listrik mengacu pada jumlah muatan listrik, biasanya diukur dalam liontin.
Hukum elektrolisis kedua Faraday
Untuk sejumlah listrik (muatan listrik) tertentu, massa unsur kimia yang akan disimpan pada elektroda selama elektrolisis berbanding lurus dengan massa ekuivalen unsur tersebut. Massa ekuivalen suatu zat adalah massa molarnya dibagi dengan bilangan bulat, tergantung pada reaksi kimia yang melibatkan zat tersebut.
Atau
Jumlah listrik yang sama menyebabkan pelepasan massa yang setara dari berbagai zat pada elektroda selama elektrolisis. Untuk membebaskan satu mol ekuivalen zat apapun, diperlukan pengeluaran listrik yang sama besarnya, yaitu 96485 C. Tetapan elektrokimia ini disebut nomor Faraday.
Hukum Faraday dalam bentuk matematika
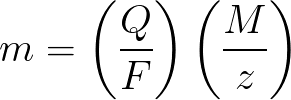
-
m adalah massa zat yang disimpan pada elektroda;
-
Q adalah nilai muatan listrik total pada liontin, yang dilewatkan selama elektrolisis;
-
F = 96485,33 (83) C / mol — Bilangan Faraday;
-
M adalah massa molar unsur dalam g/mol;
-
z — jumlah valensi ion suatu zat (elektron per ion);
-
M / z — massa setara zat yang diterapkan pada elektroda.
Diterapkan pada hukum elektrolisis pertama Faraday, M, F, dan z adalah konstanta, jadi semakin banyak Q, semakin banyak m.
Dalam hukum elektrolisis kedua Faraday, Q, F dan z adalah konstanta, jadi semakin banyak M / z, semakin banyak m.
Untuk arus searah kita punya
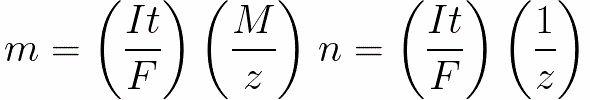
-
n adalah jumlah mol (jumlah zat) yang dilepaskan pada elektroda: n = m / M.
-
t adalah waktu lewatnya arus searah melalui elektrolit. Untuk arus bolak-balik, muatan total dijumlahkan dari waktu ke waktu.
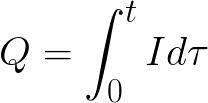
-
t adalah total waktu elektrolisis.
Contoh penerapan hukum Faraday
Penting untuk menulis persamaan proses elektrokimia di katoda dan anoda selama elektrolisis larutan natrium sulfat berair dengan anoda inert. Solusi untuk masalah tersebut adalah sebagai berikut. Dalam larutan, natrium sulfat akan berdisosiasi menurut skema berikut:
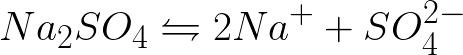
Potensi elektroda standar dalam sistem ini adalah sebagai berikut:
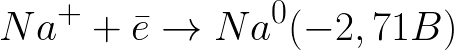
Ini adalah tingkat potensial yang jauh lebih negatif daripada elektroda hidrogen dalam media netral (-0,41 V). Oleh karena itu, pada elektroda negatif (katoda), disosiasi elektrokimia air akan dimulai dengan pelepasan ion hidrogen dan hidroksida sesuai dengan skema berikut:
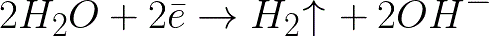
Dan ion natrium bermuatan positif yang mendekati katoda bermuatan negatif akan terakumulasi di dekat katoda, di bagian larutan yang berdekatan.
Oksidasi elektrokimia air akan terjadi pada elektroda positif (anoda), yang akan menyebabkan pelepasan oksigen, sesuai dengan skema berikut:
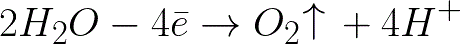
Dalam sistem ini, potensial elektroda standar adalah +1,23 V, jauh di bawah potensial elektroda standar yang ditemukan dalam sistem berikut:
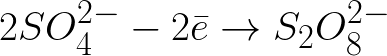
Ion sulfat bermuatan negatif yang bergerak menuju anoda bermuatan positif akan terakumulasi di ruang dekat anoda.

