Elektron berperilaku seperti gelombang
Fisikawan telah lama mengetahui bahwa cahaya adalah gelombang elektromagnetik. Hingga hari ini, tidak ada yang meragukan posisi ini, karena cahaya dengan jelas menunjukkan semua tanda perilaku gelombang: gelombang cahaya dapat saling tumpang tindih, menghasilkan pola interferensi, mereka juga dapat berpisah, membelok di sekitar rintangan selama waktu difraksi.
Ketika kita melihat seekor burung yang berjalan seperti bebek, berenang seperti bebek, dan bersuara seperti bebek, kita menyebut burung itu sebagai bebek. Jadi cahayanya gelombang elektromagnetikberdasarkan tanda-tanda yang diamati secara objektif dari perilaku gelombang semacam itu dalam cahaya.

Namun, pada akhir abad ke-19 dan ke-20, fisikawan mulai berbicara tentang «dualisme gelombang partikel» cahaya. Ternyata pengetahuan bahwa cahaya adalah gelombang elektromagnetik tidak semua yang diketahui ilmu pengetahuan tentang cahaya. Para ilmuwan telah menemukan fitur yang sangat menarik dalam cahaya.
Ternyata entah bagaimana cahaya memanifestasikan dirinya sebagai perilaku aliran partikel.Ditemukan bahwa energi yang dibawa oleh cahaya, setelah dihitung selama jangka waktu tertentu oleh detektor khusus, ternyata tetap terdiri dari bagian-bagian individu (utuh).
Oleh karena itu, menjadi benar bahwa energi cahaya adalah diskrit, karena ia tersusun dari partikel-partikel individual - "kuanta", yaitu, dari seluruh bagian energi yang terkecil. Partikel cahaya seperti itu, yang membawa satu unit (atau kuantum) energi, kemudian disebut foton.
Energi satu foton ditemukan dengan rumus berikut:
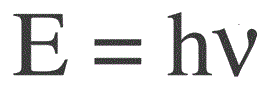
E - energi foton, h - konstanta Planck, v - frekuensi.
Fisikawan Jerman Max Planck pertama kali secara eksperimental menetapkan fakta diskresi gelombang cahaya dan menghitung nilai konstanta h, yang muncul dalam rumus untuk menemukan energi foton individu. Nilai ini ternyata: 6,626 * 10-34 J * s. Planck menerbitkan hasil karyanya pada akhir 1900-an.

Perhatikan, misalnya, sinar ungu. Frekuensi cahaya tersebut (f atau v) adalah 7,5 * 1014 Hz Konstanta Planck (h) adalah 6,626 * 10-34 J * s. Artinya, energi foton, (E), karakteristik warna ungu, adalah 5 * 10-19 J. Ini adalah porsi energi yang sangat kecil sehingga sangat sulit untuk ditangkap.
Bayangkan aliran gunung - mengalir sebagai satu kesatuan, dan tidak mungkin untuk melihat dengan mata telanjang bahwa aliran itu sebenarnya terdiri dari molekul air individu. Namun, hari ini, kita tahu bahwa objek makroskopik—aliran—sebenarnya diskrit, yaitu terdiri dari molekul-molekul individual.
Ini berarti bahwa jika kita dapat menempatkan penghitung molekul di sebelah aliran untuk menghitung molekul air yang lewat saat aliran mengalir, detektor akan selalu hanya menghitung seluruh jumlah molekul air, bukan sebagian.
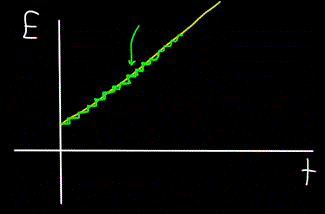
Demikian pula, grafik energi total foton E, yang dihitung pada waktu t — akan selalu menjadi tidak linier (gambar kuning), tetapi bertahap (gambar hijau):
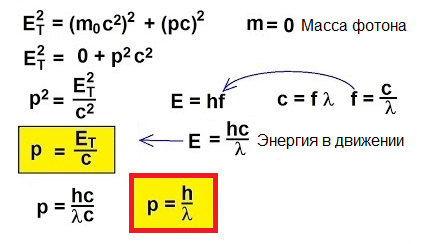
Jadi, foton bergerak, mereka membawa energi, oleh karena itu mereka memiliki momentum. Tapi foton tidak memiliki massa. Lalu bagaimana Anda dapat menemukan momentum?
Nyatanya, untuk benda yang bergerak dengan kecepatan mendekati kecepatan cahaya, rumus klasik p = mv sama sekali tidak dapat diterapkan. Untuk memahami cara menemukan momentum dalam kasus yang tidak biasa ini, mari beralih ke relativitas khusus:
Pada tahun 1905, Albert Einstein menjelaskan dari sudut pandang ini efek fotoelektrik… Kita tahu bahwa pelat logam memiliki elektron di dalamnya, yang di dalamnya ditarik oleh inti atom yang bermuatan positif dan karenanya tertahan di dalam logam. Tetapi jika Anda menyinari pelat seperti itu dengan cahaya dengan frekuensi TERTENTU, maka Anda dapat menjatuhkan elektron dari pelat tersebut.
Seolah-olah cahaya berperilaku seperti aliran partikel dengan momentum, dan meskipun foton tidak memiliki massa, ia masih berinteraksi dengan elektron dalam logam, dan dalam kondisi tertentu foton dapat melumpuhkan elektron.
Jadi jika suatu peristiwa foton pada pelat memiliki energi yang cukup, maka elektron akan terlempar keluar dari logam dan bergerak keluar dari pelat dengan kecepatan v. Elektron yang terlempar seperti itu disebut fotoelektron.
Karena elektron yang terlempar memiliki massa m yang diketahui, ia akan memiliki energi kinetik tertentu mv.
Energi foton, ketika bekerja pada logam, diubah menjadi energi keluarnya elektron dari logam (fungsi kerja) dan menjadi energi kinetik elektron, yang dimiliki oleh elektron yang terlempar mulai bergerak. keluar dari logam, meninggalkannya.
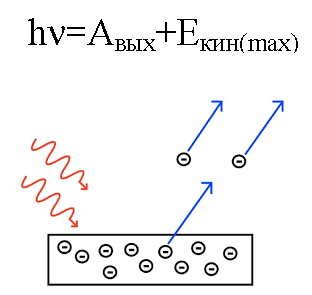
Misalkan sebuah foton dengan panjang gelombang yang diketahui mengenai permukaan logam yang fungsi kerjanya (elektron dari logam) diketahui. Dalam hal ini, energi kinetik elektron yang dipancarkan dari logam tertentu dapat dengan mudah ditemukan, serta kecepatannya.
Jika energi foton tidak cukup untuk elektron melakukan fungsi kerja, maka elektron tidak dapat meninggalkan permukaan logam tertentu dan fotoelektron tidak terbentuk.
Pada tahun 1924, seorang fisikawan Perancis Louis de Broglie mengedepankan ide terobosan yang menurutnya tidak hanya foton cahaya tetapi elektron itu sendiri dapat berperilaku seperti gelombang. Ilmuwan bahkan menurunkan rumus untuk panjang gelombang hipotetis elektron. Gelombang ini kemudian disebut "gelombang de Broglie".
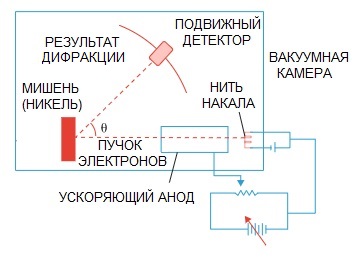
Hipotesis De Broglie kemudian dikonfirmasi. Eksperimen fisika tentang difraksi elektron, yang dilakukan pada tahun 1927 oleh ilmuwan Amerika Clinton Davison dan Lester Germer, akhirnya menunjukkan sifat gelombang elektron.
Ketika seberkas elektron diarahkan melalui struktur atom khusus, tampaknya detektor seharusnya merekam gambar sebagai partikel yang terbang satu demi satu, yang secara logis diharapkan jika elektron adalah partikel.
Namun dalam praktiknya kami memiliki gambaran karakteristik difraksi gelombang. Selain itu, panjang gelombang ini sepenuhnya sesuai dengan konsep yang dikemukakan oleh de Broglie.
Pada akhirnya, ide de Broglie memungkinkan untuk menjelaskan prinsip model atom Bohr, dan kemudian memungkinkan Erwin Schrödinger untuk menggeneralisasi ide-ide ini dan meletakkan dasar fisika kuantum modern.
